보건복지부(장관 조규홍)는 6월 27일(목) 2024년 제6차 첨단재생의료 및 첨단바이오의약품 심의위원회(이하 ‘심의위원회’)를 개최하였다.
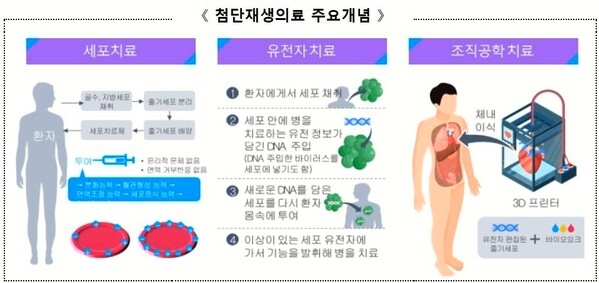
이번 심의위원회에서는 고려대학교 안암병원(병원장 한승범), 분당차병원(병원장 윤상욱) 등에서 제출한 임상연구계획 총 4건 (고위험 1건, 저위험 3건)과 장기추적계획 1건의 심의를 진행하여 이 중 3건은 적합 의결, 2건 부적합 의결하고 0건은 재심의 결정하였다.
적합 의결된 안건에 대한 주요 내용은 다음과 같다.
첫 번째 안건은 회전근개 대파열 또는 광범위 파열로 복원술을 시행 받는 환자에게 동종 탯줄유래 중간엽줄기세포를 투여하는 치료법의 안전성을 확인하기 위한 연구로서, 투여할 줄기세포의 내약성 및 안전성뿐만 아니라 회전근개 재생촉진 및 복원 효과를 탐색해볼 수 있을 것으로 기대된다.
해당 연구는 고려대학교 안암병원과 서울특별시 보라매병원이 함께 수행하는 다기관 임상연구이며, 동종 탯줄 유래 중간엽줄기세포를 사용하는 고위험 연구로서 두 재생의료기관은 식품의약품안전처장의 승인을 받은 후 임상연구를 실시하게 된다.
두 번째 안건은 안구함몰 환자에게 기존 치료 방법인 히알루론산 주사와 함께 자가 지방에서 얻은 기질혈관분획을 적용하여, 함몰된 안구를 교정하는 것을 목적으로 하는 저위험 임상연구이다.
이는 지난 제5차 심의위원회(5.23)에서 한 차례 논의된 바 있는 재심의 과제이다.
당시 위원회는 연구대상자 선정기준과 연구설계에 보완이 필요하다고 판단하여 재심의 결정을 하였고, 연구자가 보완하여 제출한 연구계획에 대해 이번 심의위원회에서 최종 적합 의결하였다.
해당 연구는 기질혈관분획을 기존의 히알루론산 주사와 병합 투여함으로써 안구함몰 환자의 시기능 개선도를 향상하여 환자의 삶의 질을 높일 수 있을 것으로 기대된다.

세 번째 안건은 ATORM-C*를 투여받은 베체트 장염 환자를 대상으로 장기 안전성 및 유효성 확인을 위한 장기추적조사 계획이다.
자가 장 상피 줄기세포를 분리한 후 오가노이드 배양기술로 증식시킨 세포치료제
심의위원회는 임상연구계획 심의 시 연구의 위험도(고·중·저)와 사용 인체세포등을 고려하여 해당 연구 수행 완료 후에도 연구대상자의 이상반응 발생여부 등 안전성에 대한 장기적인 관찰이 필요하다고 판단되는 경우 ‘장기추적조사’를 시행토록 의결한다.
이 경우 첨단재생의료 안전관리기관(질병청 국립보건연구원)에서 연구책임자와 함께 논의하여 장기추적조사 계획을 수립한다.
이번 장기추적조사 계획은 2022년 6월에 적합 의결되었던 중위험 임상연구*에 대한 것으로, 해당 계획이 심의위원회에서 적합 의결됨에 따라, 장기추적조사 참여에 동의한 ATORM-C를 투여받은 베체트 장염 환자를 대상으로 ATORM-C 투여 후 12개월부터 36개월까지 6개월 간격으로 추적 관찰이 진행될 예정이다.
베체트 장염환자에서 ATORM-C의 안전성 및 유효성 평가 연구
아울러 이날 심의위원회에서는 임상연구에 참여하는 모든 연구자가 연구와 관련된 이해상충(Conflict of Interest)이 있는지를 스스로 점검하고, 적절한 조치사항을 마련할 수 있도록 연구자를 위한 ‘이해상충 가이드라인(안)’에 대한 논의를 진행하였다.
한편, 사무국은 재생의료기관의 임상연구에 대한 접근성을 높이고, 연구계획 작성?제출을 지원하기 위해 찾아가는 임상연구 설명회를 지속적으로 개최하고 있으며, 6월 분당차병원(6월28일, 금)에 이어 7월에는 울산대병원(7월10일, 수)을 찾아가 연구자들을 직접 만날 예정이다.














